Демихова О.В.1, Балакшин В.В.2, Преснова Г.А.2, Бочарова И.В.1, Лепеха Л.Н.1, Черноусова Л.Н.1, Смирнова Т.Г.1, Поспелов Л.Е.1, Чистяков А.Н.2
1 – ГУ ЦНИИТ РАМН, Москва
2 – ООО «Березовый мир»
Во всем мире интенсивно ведется поиск новых эффективных лекарственных препаратов для лечения туберкулеза. Микобактерия является внутриклеточным паразитом, что затрудняет борьбу с этим инфекционным заболеванием. В настоящее время имеются мощные противотуберкулезные препараты, разработанные в середине прошлого столетия, которые часто применяются комплексно (4, 5 и более препаратов одновременно). Эти химиопрепараты приходится применять в течение длительного времени –от полугода и более. К сожалению, нередки случаи непереносимости ряда химиопрепаратов, а также возникновения побочных реакций. Поэтому задача по поиску новых лекарственных средств, применение которых совместно с противотуберкулезными препаратами ускоряло бы процесс лечения и помимо этого снижало токсическое действие этих препаратов на человека важна и актуальна.
Благодаря установленной высокой антибактериальной активности по отношению к микобактерии туберкулеза и выраженному положительному влиянию на репаративные процессы в тропных к туберкулезной инфекции органах, перспективным в этом отношении может быть препарат природного происхождения — сухой экстракт бересты (БЭС), содержащий тритерпеновый спирт – бетулин (бетулинол).
Целью нашего исследования было изучение антимикобактериальной активности продукта сухого экстракта бересты при лечении экспериментального туберкулеза легких, для чего были поставлены следующие задачи:
- изучить антимикобактериальное действие препарата in vitro в культуре микобактерий (МБТ).
- изучить антибактериальное действие препарата in vitro в культуре макрофагов (МФ), зараженных микобактериями туберкулеза.
- выяснить специфическую активность БЭС на модели активного экссудативно-некротического туберкулеза in vivo.
4. Выявить возможные морфологические изменения в тропных к туберкулезной инфекции органах при воздействии на них БЭС.
Материалы и методы
Определение специфической активности препарата БЭС с содержанием бетулинола 70% проводили на самцах инбредных мышей линии С57ВL/6 , полученных из вивария ГУ ЦНИИТ РАМН. Вес мышей – 20 грамм. Мышей заражали внутривенным введением M. tuberculosis (МБТ) штамма Н37Rv из коллекции института Пастера (Франция) в ретроорбитальный синус глаза в дозе 5х106КОЕ (колониеобразующие единицы).
Все экспериментальные животные были разделены на следующие группы:
1 группа – интактные животные –15 гол.
2 группа – инфицированные животные, не получающие лечения – 15 гол.
3 группа – инфицированные животные, получающие комбинацию противотуберкулезных препаратов ( изониазид +рифампицин) – ПТП — в дозе 38 мг/кг-15 гол.
4 группа – инфицированные животные, получающие ПТП в стандартной дозе и БЭС в дозе 25 мг/кг- 15 гол.
5 группа – инфицированные животные, получающие ПТП в стандартной дозе и БЭС в дозе 50 мг/кг- 15 гол.
6 группа – инфицированные животные, получающие БЭС в дозе 25 мг/кг- 15 гол
7 группа — инфицированные животные, получающие БЭС в дозе 50 мг/кг – 15 гол
Препараты вводили внутрижелудочно, ежедневно, в течение 2 месяцев, через две недели после заражения. Через 2 месяца половину живых животных выводили из эксперимента методом цервикальной дислокации для микробиологических и гистологических исследований.
Для гистологического изучения кусочки легкого, печени и селезенки фиксировали 10% забуференным формалином, заключали в парафин, готовили гистологические срезы, которые окрашивали гематоксилином и эозином.
Определение влияния препарата на микобактериальную культуру в различных разведениях проводили в 96-луночных планшетах. Для этого к культурам М.tuberculosis добавляли препарат в разных концентрациях и инкубировали в течение 48 часов в СО2-инкубаторе. За 18 часов до истечения срока инкубации в лунки добавляли метку – 5,6[3Н] — урацил. После окончания времени инкубации производили измерение количества включенной в живые микобактерии метки на жидкостном сцинтилляторе. Об активности исследуемых препаратов судили по количеству включенной метки в живые микобактерии по сравнению с интактным контролем. Все измерения проводились в трипликатах.
Определение влияния исследуемого препарата на микобактерии в культуре макрофагов проводили на перитонеальных макрофагах мышей линии C57Bl/6.
Заражение макрофагов микобактериями осуществляли в плоскодонных 96-луночных планшетах в среде RPMI c 2% FCS. Жизнеспособность микобактерий в смешанной культуре с макрофагами оценивали по избирательному включению в M.tuberculosis –5,6 -[3Н]-урацила. Перед подсчетом включенной метки (CPM) макрофаги разрушались замораживанием при -80°С.
Результаты исследований.
Основными показателями резистентности животного к туберкулезу являются срок выживаемости после инфицирования и степень патологических изменений легочной ткани.
Как показали исследования, у мышей контрольной группы, не получавших никаких препаратов, выживаемость после смертельной дозы заражения составила 31±2.07 дней, а мыши, получавшие БЭС в дозе 50мг/кг – 37,86 ±2.48 дней (р<0.05). Мыши, получавшие ПТП совместно с БЭС, оставались живы в течение всего эксперимента.
Для выявления антимикобактериального эффекта исследуемого препарата было испытано как прямое воздействие БЭС (в концентрациях 160, 80, 40, 2, 0,2 и 0,02 мкг/мл) на микобактерии, так и эффект БЭС на микобактерии, фагоцитированные макрофагами. Результаты представлены на диаграммах 1, 2. Как видно из диаграммы 1, при прямом воздействии на микобактерии БЭС оказывал ингибирующее действие во всех концентрациях. Наибольшее ингибирующее воздействие препарат оказывал в высоких концентрациях (80 и 160 мкг/мл).
При изучении воздействия разных концентраций БЭС на микобактерии, фагоцитированные макрофагами, было показано, что ингибиция роста микобактерий была достоверна при воздействии БЭС в высоких дозах (160 мкг/мл) на микобактерии, фагоцитированные макрофагами в соотношении МФ:МБТ 1:5 (диагр.2). При этом процент ингибиции роста микобактерий составил 38,63%.
Исходя из полученных данных об ингибировании БЭС роста микобактерий в питательной среде, а также ингибировании роста микобактерий, фагоцитированных перитонеальными макрофагами, было важно сравнить цитотоксическое действие, которое оказывают микобактерии на макрофаги без препарата и в присутствии БЭС. В эксперименте были использованы как высокие концентрации препарата (40, 80 и 160 мкг/мл), так и концентрации, не оказывающие цитотоксического эффекта на макрофаги (2,0, 0,2 и 0,02мкг/мл).
Результаты представлены на диаграмме 3.
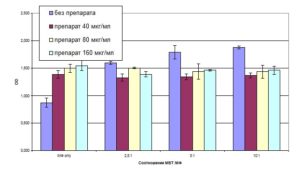
Как видно из диагр. 3, специфический лизис макрофагов, зараженных микобактериями (контроль, без воздействия БЭС) был высоким при всех соотношениях МФ:МБТ и среднее значение оптической плотности (OD) колебалось от 1,6 (МФ:МБТ 1:1,25) до 1,88 (МФ:МБТ 1:10), что было достоверно выше спонтанного разрушения макрофагов (OD=0,87). , БЭС в высоких концентрациях (40, 80, 160 мкг/мл) уменьшал специфический лизис макрофагов, происходящий при заражении микобактериями
Исходя из полученных данных, можно сделать вывод, что у БЭС наблюдается антимикобактериальный эффект, требующий в дальнейшем более детального изучения.
Диаграмма 1. Жизнеспособность микобактерий туберкулеза при воздействии БЭС (по избирательному включению 5,6-[3Н]-урацила в живые клетки).
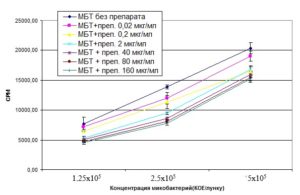
Диаграмма 2. Жизнеспособность микобактерий туберкулеза, фагоцитированных макрофагами, при воздействии БЭС в разных концентрациях (по избирательному включению 5,6-[3Н]-урацила в живые клетки).
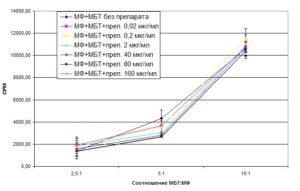
Диаграмма 3. Специфический лизис незараженных макрофагов и макрофагов, фагоцитировавших микобактерии в разных соотношениях (в присутствии БЭС в высоких концентрациях и без препарата ). Выход ЛДГ из макрофагов в среду рассчитан по цветной ферментативной реакции. Данные представлены как среднее значение оптической плотности (OD) из трех определений со стандартным отклонением.
Гистологические исследования показали, что у зараженных нелеченных животных через 1 месяц в легких наблюдались большие пневмонические фокусы с крупными инфильтратами, содержащими макрофагальные и лимфоидные элементы. В печени также наблюдались крупные периваскулярные инфильтраты.
У зараженных МБТ мышей, получавших 2 месяца противотуберкулезные препараты (3 гр.), в легких преобладала воздушная паренхима. Вокруг сосудов мелкого и среднего калибра формировались небольшие клеточные инфильтраты (пневмонические фокусы), содержащие зрелые макрофагальные и лимфоидные элементы; нейтрофильные лейкоциты выявляли относительно редко. В просветах сосудов можно было видеть единичные эозинофильные лейкоциты, что отражает развитие у мышей аллергической реакции на противотуберкулезные препараты. Несмотря на лечение, в макрофагах содержались видоизмененные микобактерии.
В печени изменения гепатоцитов отражали процессы регенерации (гипертрофия цитоплазмы, появление двух ядер). В перипортальной зоне наблюдали небольшие лимфоидно-макрофагальные инфильтраты, в составе которых выявляли единичные нейтрофилы.
Для селезенки большинства животных 3 группы была характерна диффузная, реже локальная, инфильтрация белой и красной пульпы мононуклеарами разной степени зрелости. В отдельных случаях выявляли крупные многоядерные макрофаги с темной цитоплазмой.
В то же время у мышей 4-й и 5-ой групп, получавших комплексное лечение противотуберкулезными препаратами в сочетании с БЭС, паренхиматозные органы имели наиболее близкое к норме гистологическое строение, пневмонические фокусы не определялись. Наблюдали небольшие периваскулярные скопления мононуклеаров без выявления нейтрофильных лейкоцитов. Большая часть легочной паренхимы сохраняла воздушность. Аналогичные лимфоидно-макрофагальные скопления наблюдали в перипортальной зоне печени. В белой пульпе селезенки отмечалась гипертрофия мальпигиевых телец. Они имели хорошо выраженные светлые центры, которые содержали значительное число лимфобластов и лимфоцитов. Трабекулярная сеть была заметно утолщена за счет активации клеток соединительной ткани и выраженного фибриллогенеза. Небольшие скопления мононуклеаров редко содержали многоядерные макрофаги. Таким образом, экспериментальное испытание препарата БЭС у мышей с моделью экссудативно-некротического туберкулеза показало его положительное влияние на процессы заживления и восстановления структурно-функциональных особенностей легких и других паренхиматозных органов при длительном его применении на фоне специфической антибактериальной терапии. В сочетании с противотуберкулезными препаратами БЭС позволил получить более выраженное сокращение площади воспалительного процесса по сравнению с традиционным лечением. Более того, у животных, получавших этот препарат 2 месяца, наблюдали более полное восстановление структуры легких, печени и селезенки, по сравнению с обычным этиотропным лечением.
ВЫВОДЫ
1. Введение БЭС в дозе 50мг/кг после заражения микобактериями туберкулеза статистически достоверно увеличивало срок жизни экспериментальных животных по сравнению с контролем.
2. Препарат БЭС ингибировал рост микобактерий туберкулеза во всех исследованных
концентрациях in vitro, но максимально в концентрациях 80 и 160 мкг/мл
3. Введение БЭС в схему стандартной специфической антибактериальной терапии
показало выраженное положительное влияние препарата БЭС на репаративные
процессы в легких, печени и селезенке у экспериментальных животных.
4. Введение БЭС в высоких концентрациях в культуру макрофагов уменьшало
специфический лизис макрофагов, происходящий при заражении микобактериями.
ЗАКЛЮЧЕНИЕ.
Полученные результаты исследования антимикобактериальной активности БЭС : увеличение сроков выживания экспериментальных мышей при монотерапии БЭС, его ингибирующая активность на МБТ in vitro и in vivo , улучшение процессов репарации в тропных к туберкулезу органах свидетельствуют о целесообразности проведения клинических испытаний препарата в комплексном лечении больных туберкулезом.
