Дубинская В.А.*,Минеева М.Ф.*, Тополева Т.В.**, Балакшин В.В.** Е.А.Воротеляк*** А.В.Васильев***
* НИЦ БМТ ВИЛАР
** ООО «Березовый мир»
*** ИНСТИТУТ БИОЛОГИИ РАЗВИТИЯ ИМ. Н.К. КОЛЬЦОВА РАН
Поиск новых природных эффективных антиоксидантов – актуальная проблема современной (косметологии, дерматологии, медицины).
По оригинальной технологии компания «Березовый мир» производит экстракт бересты сухой с различным содержанием тритерпеноидов, основным из которых является бетулин. Из бересты был получен суммарный препарат, содержащий 60-74% бетулина. Кроме бетулина, препарат содержит бетулиновую кислоту, лупеол, уваол, кофеат бетулина олеаноловую кислоту].
Бетулин (синонимы: бетулинол, бетулол, лупендиол), структурная формула которого приведена на рис.1, представляет собой пентациклический тритерпеновый спирт ряда лупана – луп-20(29) –ен-3,28-диол.
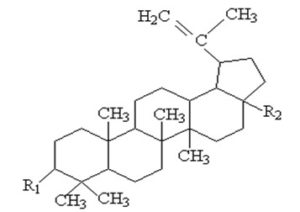
R1 = -OH; R2 = -CH2OH ≈ бетулин
Рис. 1 Структурная формула бетулина
Согласно литературным данным, пентациклический тритерпен бетулин, бетулиновая кислота и родственные им соединения обладают противовирусной, антибактериальной, противогрибковой, противовоспалительной, гиполипидемической, желчегонной, гепатопротекторной активностью [1-3].
Бетулин и его аналоги широко изучаются как антиоксидантные средства[4]. По данным индийских авторов[5] бетулин и структурно близкий ему лупеол могут положительно влиять на нарушенный антиоксидантный статус организма.
Kомпания «Березовый мир» с 2000 года занимается исследованиями в области применения Бересты экстракта сухого (БЭС).
В настоящей статье представлены материалы скринингового изучения антиоксидантных свойств образца БЭС ООО “Березовый мир”.
Материалы и методы
Биологические испытания образца Бересты экстракта сухого проводили в условиях
in vitro Для выявления наличия антиоксидантных свойств образца использовали
специфические ферментные тест-системы in vitro.
Антиоксидантную активность образца выявляли с использованием специфических молекулярных тест-систем in vitro [6], в которых в качестве тест-объектов использовали антиоксидантные ферменты – каталазу (КАТ) и глутатионпероксидазу (ГП), а также фермент антиоксидантной защиты глутатионредуктазу (ГР) — ключевой фермент восстановительного глутатионового цикла.
В работе использовали препараты ферментов — ГР, ГП, КАТ, глутатион окисленный, глутатион восстановленный, b-никотинамидадениндинуклеотид фосфат восстановленный (b-НАДФН) фирмы “Sigma”. Концентрация белка ферментов в инкубационной пробе составляла 0,3 – 0,5 мкг/мл. Исследуемые вещества растворяли в дистиллированной воде в присутствии 1% твина-80 и добавляли в пробу в конечной концентрации 1, 10, 50, и 100 мкг/мл.
Для определения скорости ферментативных реакций использовали известные спектрофотометрические методики в нашей модификации. Скорость ГР и ГП реакций определяли по убыли поглощения НАДФН при длине волны 340 нм [7]. Об активности КАТ судили по убыли субстрата – гидроперекиси, измеряя убыль поглощения комплекса гидроперекиси с молибдатом аммония при 410 нм [8]. Измерения проводили на двулучевом регистрирующем спектрофотометре Shimadzu MPS-2000. Скорость ферментативных реакций измеряли без добавления изучаемого вещества (контроль) и после добавления изучаемого вещества в пробу (опыт). В табл. 1 приводятся средние арифметические значения из 2-х (для ГР и ГП) и 4-х (для КАТ) параллельных определений и стандартные отклонения среднего результата (M ± m).
Результаты исследования и обсуждение.
1. Биохимическое тестирование in vitro
Для первичной оценки антиоксидантной активности образца БЭС применяли разработанные в НИЦ БМТ ВИЛАР оригинальные специфические биотест-системы in vitro. В качестве тест-объектов использовали ферменты антиоксидантной защиты: ГР, КАТ и ГП. Каждая из этих ферментных тест-систем позволяет оценить изучаемый образец по одному биологическому параметру.
В табл.1 представлены результаты влияния образцов бетулина на скорость КАТ, ГП, ГР реакций в условиях in vitro.
Табл. 1
Влияние образца БЭС на активность ферментов антиоксидантной защиты in vitro
| Образец, концентрация | Скорость ферментативной реакции, M +/- m | ||||||
| КАТ | ГП | ГР | |||||
| мкмоль
мин.*мг |
% | мкмоль
мин.*мг |
% | мкмоль
мин.*мг |
% | ||
| 1. Контроль | 8,39±0,17 | 100,0 | 2,88±0,12 | 100,0 | 12,90±0,32 | 100,0 | |
| 2.Образец БЭC,
1 мкг/мл 10мкг/мл 50мкг/мл 100мкг/мл |
8,40±0,15
8,56±0,08 9,26±0,04* 9,92±0,21* |
100
102 110* 118* |
2,86±0,09
3,07±0,14 3,39±0,05* 4,44±0,24* |
99
107 118* 154* |
12,56±0,26
14,08±0,14* 13,84±0,22 13,48±0,07 |
97
109* 107 105 |
|
* — достоверность отличий от контроля при р < 0,05
Из табл.1 видно, что изучавшийся образца БЭС влияет на скорость КАТ, ГП, ГР реакций, и это влияние зависит от концентрации образца в пробе.
Из табл.1 видно, что изучавшийся образец БЭС влияет на скорость КАТ, ГП, ГР реакций, и это влияние зависит от концентрации образца в пробе. Скорость глутатионпероксидазной реакции для образца максимальна наблюдается при концентрации 100 мкг/мл. Образец in vitro активируют не только ГП, но и ГР, что, учитывая установленную нами корреляцию активации ферментов антиоксидантной защиты in vitro с антиоксидантным действием биологически активных веществ [9], свидетельствует о наличии у образца антиоксидантных свойств.
Следует отметить, что наиболее выраженный активирующий эффект наблюдался в отношении глютатионпероксидазы, основная функциональная роль которой состоит в разрушении органических перекисей, прежде всего перекисей липидов
Таким образом, по данным биохимического тестирования in vitro можно полагать, что Бересты экстракт сухой, полученный по оригинальной технологии ООО «Березовый мир», может обладать достаточно широким спектром фармакологического действия, проявлять антиоксидантные и адаптогенные свойства.
Выводы:
· образец БЭС производства ООО «Березовый мир» в экспериментах in vitro с использованием патентованных специфических ферментных тест-систем проявляют свойства, присущие антиоксидантам и адаптогенам.
По результатам полученных данных было проведено скрининговое тестирование образца БЭС in vitro на клетках кожи человека, определялось влияние образца на рост клеток кожи, их функциональную активность. [10 ]
Список сокращений
PBS — фосфатно-солевой буфер
ЭКЦ – эпидермальные кератиноциты человека
Материалы и методы
Список сокращений
PBS — фосфатно-солевой буфер
ЭКЦ – эпидермальные кератиноциты человека
Материалы и методы
1. Выделение и культивирование эмбриональных фибробластов человека
Эмбриональные фибробласты человека получали из 3 — 5 нед. абортивного материала с помощью трипсинизации. Фибробласты культивировали в среде Игла с глутамином (0,3мг/мл) и 10% эмбриональной сыворотки в СО2 инкубаторе при 370С. Смену среды проводили через каждые 3-4 дня, культуры пассировали при достижении конфлуентного слоя.
2. Изучение влияния блокаторов кальциевых каналов на синтез ДНК в эмбриональных фибробластах человека.
В исследовании использовались диплоидные эмбриональные фибробласты человека 3-20 пассажей.
Клеточную суспензию (50 тыс.кл/мл) в среде Игла с 10% эмбриональной телячей сыворотки в объеме 1 мл вносили в лунки 24-луночного плата. Плата инкубировали при температуре 370 С в атмосфере 5% СО2 и насыщающей влажности. Через 72 часов производили смену среды на Игла с 0,5% сыворотки. Еще через 48 часов стимулировали пролиферацию внесением свежей питательной среды с 10 % сыворотки. Одновременно в четыре вертикальных ряда лунок вносили исследуемый препарат в различных концентрациях. Первые два ряда лунок служили контролем и в них препарат не вносился. В первый ряд вносили среду с 10% сыворотки, во второй — с 0,5 % сыворотки. Кроме этого, во все лунки добавляли 3Н-тимидин (0,5 мкКи/мл, уд. акт. 48,6 Ки/ммоль). Клетки инкубировали в указанных условиях 48 часов. После этого плата дважды тщательно промывали раствором Хенкса и дважды фиксировали в 1мл 5% холодной трихлоруксусной кислоте при 40 С. Затем клетки дважды промывали раствором Хенкса для удаления несвязавшейся радиоактивности, тщательно удаляли жидкость из лунок и лизировали клетки добавлением в лунки по 200 мкл 0,1 N NaOH. Плата инкубировали при 370 С в течение 30 мин. После окончания инкубации вносили лизат в 1,5 мл сцинтилляционной жидкости, выдерживали в холодильнике по крайней мере в течение 30 мин. и определяли радиоактивность включившегося тимидина на счетчике.
3. Исследование влияния препаратов на количества общего белка в культуре клеток
Клеточную суспензию (50 тыс.кл/мл) в среде Игла с эмбриональной телячьей сывороткой, в объеме 250 мкл вносят в лунки плата. Плата инкубируют в СО2 — инкубаторе при температуре 37 С в атмосфере насыщающей влажности, содержащей 5 % CО2. Через 24 часа инкубации клеток в лунках среду меняют на свежую, содержащую исследуемые вещества. Клетки инкубируются в указанных условиях в течение 72 часов. По окончании инкубации клетки фиксируют добавлением холодного свежеприготовленного 2,5% глютарового альдегида. Через 30 мин. инкубации клеток при 40 С из лунок удаляют супернатант. Лунки дважды промывают холодным раствором Хенкса и заполняют красителем Гимза, разведенного 1:50 непосредственно перед использованием. Клетки инкубируют с красителем 3 часа при 370 С. Затем краситель удаляют, лунки дважды промывают раствором Хенкса, заполняют элюирующим раствором (0,1 М фосфатный буфер : С2Н5ОН )(1:1) и инкубируют 15 минут при перемешивании 100 об/мин и комнатной температуре. Измерение оптической плотности элюирующего раствора проводят на спектрофотометре при длине волны 620 нм.
По результатам спектрофотометрического анализа оценивают влияние исследуемых веществ на рост клеток в сравнении с контрольными результатами.
На основании проведенных исследований изучение действия БЭС на клетки кожи проводили путем внесения в культуральную среду 1%-ного раствора в кукурузном масле в 10-ти кратном разведении. Контроль – кукурузное масло.
Изучение действия БЭС на пролиферацию клеток кожи.
1.1. Исследование в культуре фибробластов человека
1.1.1. Изучение действия БЭС на прирост общего клеточного белка в культуре фибробластов человека
При внесении 0.1% БЭС количество общего белка в культуре фибробластов не изменялось В то же время следует отметить, что морфология клеток существенно отличалась от контроля, инкубированного с полной питательной средой: увеличивался размер клеток, количество цитоплазматических включений, изменялся типичный для фибробластов рисунок монослоя (рис. 5 цветной вклейки). Эти изменения носили более выраженный характер по сравнению с контрольными культурами, обработанными только кукурузным маслом без препарата.
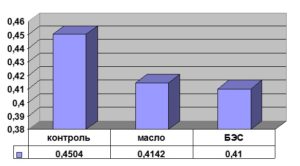
Рис. 1. Действие БЭС на содержание общего клеточного белка в культуре эмбриональных фибробластов человека
1.1.1. Изучение действия БЭС на синтез ДНК в культуре фибробластов человека
Изучение пролиферации эмбриональных фибробластов человека под действием БЭС выявило снижение темпов синтеза ДНК в опытных культурах (рис. 2).
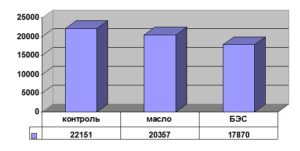
Рис. 2. Действие БЭС на синтез ДНК в культуре эмбриональных фибробластов человека
Экспериментально установлено снижение темпов пролиферации с одновременным увеличением размера клеток, что может указывать на переключение фибробластов с пролиферативной на синтетическую активность.
Вывод: Скрининговые исследования антиоксидантных свойств и влияния на клетки кожи человека серийных образцов БЭС производства ООО «Березовый мир» подтвердили антиоксидатную активность препарата и перспективность его дальнейшего изучения для применения в косметологии и дерматологии.
Литература
1. Recio M.C., Giner R.M., Manez S.,Gueho J., Julien H.R., Hostettmann K., Rios J.L. Investigations on the steroidal anti-inflammatory activity of triterpenoids from Diospyros leucomelas
2. Chowdhury A.R., Sharma S., Mandal S., Goswami A., Mukhopadhyay S., Majumder H.K. Luteolin, an emerging anti-cancer flavonoid, poisons eukariotic DNA topoisomerasa I. // Biochem. J. = 2002. — T. 336. — Pt. 2. — P. 653 – 661.
3.Zuco Y., Supino R., Righetti S.C., Cleria L., Marchesi E., Gambacorti-Passerini
C., Formelli F. Selective cytotoxicity of betulinic acid on tumor cell lines, but not on normal cells. // Cancel Lett. — 2002. — № 1. — P. 17 – 25.
4.Yamashita K., Lu H., Lu j. еt al. Effect jf three triterpenoids, lupeol,betulin, and betulinic acid on the stimulus-induced superoxide generation and tyrosil phosphorylation of proteins in human neutrophils. // Clin. Chim. Acta. – 2002 – Vol.325. – No1-2. – P.91.
5.Vidia L., Malini M.M.,Varalakshmi P. Effect of triterpenes on oxalate-induced changes in rat erythrocytes // Pharmacol.Res. – 2000. – Vol.42. — issue 4, October. – P.313-316.
6. Патент № 2181892 приоритет от 06.06.2001. — Способ выявления веществ, обладающих антиоксидантными свойствами, in vitro. — Быков В.А., Дубинская В.А., Минеева М.Ф., Ребров Л.Б., Колхир В.К.
7.Beutler E. Red cell metabolism. Ed. E.Beutler. Churchill.Livingson.. -1986.- С. 195.
8. Королюк М.А., Иванова Л.И., Майорова И.Г., Токарева В.Е. // Лаб.дело. — 1986.— № 1. — С. 16 – 19.
9. Дубинская В.А., Минеева М.Ф., Ребров Л.Б., Колхир В.К., Быков В.А. Новые ферментные тест-системы для выявления биологически активных веществ.
// Вторая международная конференция «Клинические исследования лекарственных средств» 20-22 ноября 2002 года . — М. — С. 63.
10. (А.А. Кубанова, В.А. Самсонов, А.В. Резайкина, В.П.Бухова, М.Ю. Парфенова, В.В.Терских , А.В.Васильев, Е.А.Воротеляк. Тестирование лекарственных препаратов наружного применения в культуре клеток кожи человека.- Методические рекомендации 96/247.Утверждены Заместителем Министра МЗ РФ 19 февраля 1996 г. Москва, 1996, с.1-8.
